【編者按】自2024年國辦53號文件出臺一年來,各地加快政策落地,藥監(jiān)系統(tǒng)全面深化改革、強化全鏈條監(jiān)管、優(yōu)化服務,筑牢安全底線,激活創(chuàng)新生態(tài),引領產(chǎn)業(yè)向高端突破,全國醫(yī)藥行業(yè)正形成勃發(fā)進取的新態(tài)勢。為此,新華網(wǎng)聯(lián)合國家藥監(jiān)局新聞中心推出“深化藥械改革 各地在行動”系列報道,深入解讀行業(yè)變革,記錄這場以創(chuàng)新驅(qū)動的高質(zhì)量發(fā)展歷程。
新華網(wǎng)廣州1月16日電(張悅)2025年是《國務院辦公廳關于全面深化藥品醫(yī)療器械監(jiān)管改革促進醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展的意見》實施一周年。這一年,廣東貫通聯(lián)動國家重大藥械審評審批改革,縱深推進大灣區(qū)藥械監(jiān)管創(chuàng)新,推動全省藥品產(chǎn)業(yè)高質(zhì)量發(fā)展邁出堅實步伐。
速度疊加創(chuàng)新 大灣區(qū)藥械監(jiān)管創(chuàng)新政策紅利加速釋放
廣東省以“港澳藥械通”為代表的一系列藥械監(jiān)管創(chuàng)新政策,不僅惠及粵港澳大灣區(qū)患者,也深入影響著粵港澳大灣區(qū)生物醫(yī)藥產(chǎn)業(yè)的發(fā)展。其中,“港澳藥械通”政策順利打通港澳使用的創(chuàng)新藥械快速進入臨床應用的通道,目前指定醫(yī)療機構達到71家,先后獲批引進使用港澳藥品、醫(yī)療器械146個品種,惠及患者約1.7萬人次。
中山大學附屬第一醫(yī)院副院長、膽胰外科學科帶頭人殷曉煜教授介紹,中山一院積極通過 “港澳藥械通” 政策引進先進藥械,其中醫(yī)療器械覆蓋心內(nèi)科、血管外科、耳鼻喉科、神經(jīng)外科等前沿專科,藥品則聚焦腫瘤、罕見病、心血管疾病、神經(jīng)科學等臨床急需領域,為患者提供了更多元、高效的治療選擇。
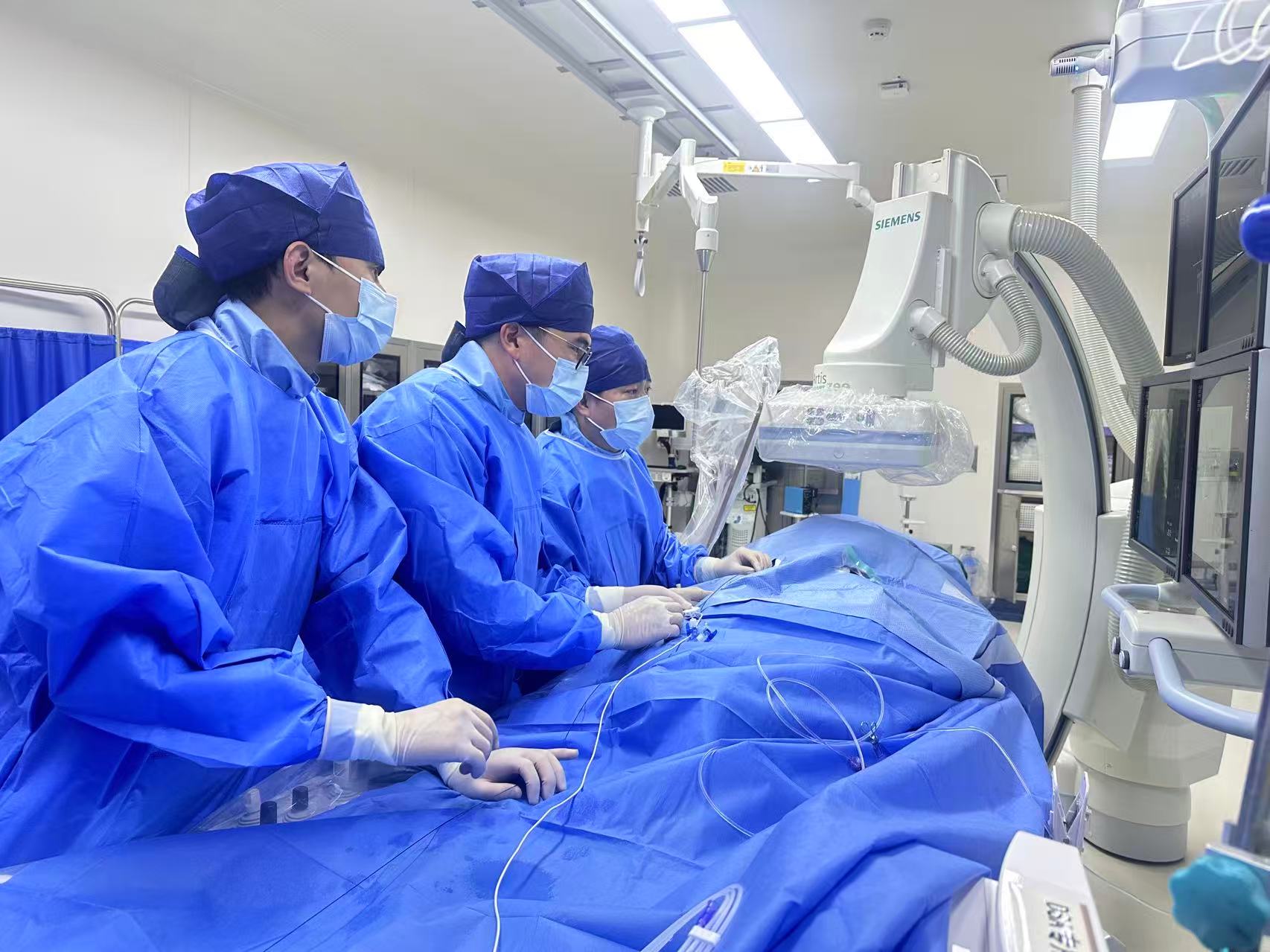
中山大學附屬第一醫(yī)院血管外科常光其教授、李梓倫教授團隊順利開展中國大陸首例EKOS超聲波輔助溶栓系統(tǒng)治療肺動脈栓塞。新華網(wǎng)發(fā)(受訪者供圖)
醫(yī)療器械方面,以EKOS超聲波輔助溶栓控制系統(tǒng)及導管為例,該產(chǎn)品是全球首款獲美國FDA批準、用于肺動脈栓塞的超聲輔助溶栓介入器械。中山一院作為大陸首家引進單位,成功開展了內(nèi)地首例該器械治療肺動脈栓塞,為本土危急重癥患者帶來了安全、有效的治療新方案。
殷曉煜表示,中山一院引進的港澳藥械,緊扣政策核心要求,兼具 “臨床急需性” 和 “應用先進性” 兩大特點,同時緊密結(jié)合患者實際需求和醫(yī)院優(yōu)勢學科布局,開展項目遴選、申報與臨床應用。
為確保患者使用安全,引進相關產(chǎn)品首先由臨床科室提出申請,經(jīng)院內(nèi)多部門評估、倫理委員會、藥事或醫(yī)療器械相關委員會審核通過后,再向廣東省藥監(jiān)局提交正式申報;獲批后,同步完成醫(yī)保編碼申請、收費項目備案等配套工作,隨后啟動臨床使用;在使用全流程中,醫(yī)院通過UDI掃碼追溯技術進行閉環(huán)管理,切實保障港澳藥械的安全可靠。
殷曉煜認為,未來深化大灣區(qū)醫(yī)療衛(wèi)生合作還可以從多方面發(fā)力。如依托 “港澳藥械通” 現(xiàn)有通道,拓展臨床急需藥械的引進范圍;聯(lián)合開展創(chuàng)新藥械真實世界研究,為港澳優(yōu)質(zhì)藥械在內(nèi)地注冊提供循證依據(jù);探索建立大灣區(qū)藥械采購協(xié)同機制,降低引進成本,提升患者對先進治療資源的可及性。建立大灣區(qū)藥械使用數(shù)據(jù)、不良反應監(jiān)測信息互通機制,實現(xiàn)用藥用械安全數(shù)據(jù)實時共享;探索急需藥械臨床使用規(guī)范、質(zhì)控標準的銜接統(tǒng)一,為跨區(qū)域藥械合理使用提供數(shù)據(jù)支撐和標準遵循等。
除“港澳藥械通”外,廣東省藥監(jiān)局還進行了系列布局進一步拓展大灣區(qū)醫(yī)藥產(chǎn)業(yè)發(fā)展空間。如簡化傳統(tǒng)外用中成藥注冊審批流程,推動18個港澳藥品簡化快速獲批內(nèi)地上市;首創(chuàng)“港澳持有+灣區(qū)內(nèi)地生產(chǎn)”管理模式,3款香港藥品實現(xiàn)灣區(qū)內(nèi)地投產(chǎn)上市;推動橫琴粵澳深度合作區(qū)使用澳門藥品,確定2批指定澳門藥品共367個品種、545個品規(guī)進入深合區(qū)供澳門居民使用。
此外,粵澳合作中醫(yī)藥科技產(chǎn)業(yè)園已注冊企業(yè)233家,其中澳門企業(yè)98家;中山市藥品進口口岸2021年增設以來,報關貨值超過10.7億元;批準廣東省中醫(yī)院、佛山市中醫(yī)院等2家醫(yī)療機構10個優(yōu)質(zhì)醫(yī)療機構中藥制劑品種,跨境至澳門鏡湖醫(yī)院臨床使用,深化粵澳醫(yī)療衛(wèi)生合作等。
政策“及時雨” 春雨行動助力醫(yī)械臨床研究成果轉(zhuǎn)化
“春雨行動”的深入實施為破解醫(yī)療器械臨床研究成果轉(zhuǎn)化中“不愿轉(zhuǎn)、不敢轉(zhuǎn)、不會轉(zhuǎn)”的難題提供了關鍵解決方案。今年7月,廣東省藥監(jiān)局在廣州生物島舉行春雨行動政策宣貫交流會,聚焦產(chǎn)業(yè)鏈協(xié)同,促進以臨床價值為導向的醫(yī)療器械源頭創(chuàng)新。
據(jù)了解,目前已有182個項目進入第二輪綜合評選,其中三類醫(yī)療器械項目96個、創(chuàng)新產(chǎn)品項目71個、首個產(chǎn)品項目118個。其中,基于長期臨床實踐與研究積累,中山大學附屬第六醫(yī)院臨床檢驗科學科帶頭人劉煥亮教授及其團隊發(fā)現(xiàn)患者術后惡心嘔吐(PONV)管理存在突出的臨床痛點,并持續(xù)探索可落地的解決方案。

2025年10月24日,廣東省“春雨行動——推進醫(yī)療器械臨床研究成果轉(zhuǎn)化”項目對接會暨平臺發(fā)布會。新華網(wǎng)發(fā)(廣東省藥監(jiān)局供圖)
劉煥亮表示,春雨行動是推動醫(yī)療器械源頭創(chuàng)新成果轉(zhuǎn)化的重要的舉措。一方面,通過廣東省藥監(jiān)局提供的醫(yī)療器械臨床研究成果轉(zhuǎn)化溝通咨詢與對接平臺,相關項目在政府、醫(yī)院、研究、企業(yè)、金融等共同參與的平臺上,讓監(jiān)管部門、產(chǎn)業(yè)界、金融機構能夠系統(tǒng)了解臨床創(chuàng)新的需求;另一方面,醫(yī)療器械臨床研究成果轉(zhuǎn)化溝通與對接平臺的存在使團隊有機會更早推進相關合作,與審評專家、企業(yè)溝通未來可能注冊的路徑和產(chǎn)品的形態(tài)。“在研究時就提前考慮轉(zhuǎn)化的要求,減少‘走回頭路’”。因此劉煥亮認為,春雨行動更像是科研成果的轉(zhuǎn)化的高能級連接器、放大器,為相關方提供了平臺溝通和交流,推動研究成果加速轉(zhuǎn)化。
劉煥亮介紹,目前團隊已經(jīng)完成了概念認證,開發(fā)了預測術后惡心嘔吐的原型系統(tǒng),完成了模型封裝、流程設計和界面的雛形,并通過進一步的臨床研究為將來落地轉(zhuǎn)化進行加碼。他也希望聯(lián)合各方,借助春雨行動加速項目轉(zhuǎn)化,進一步為健康中國助力。
加大創(chuàng)新藥械全鏈條支持 加速創(chuàng)新產(chǎn)品惠及患者
2024年10月,廣東省印發(fā)《關于進一步推動廣東生物醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展的行動方案》,從加快創(chuàng)新藥臨床試驗審評審批進程、促進創(chuàng)新藥械入院使用等多個方面推動廣東生物醫(yī)藥產(chǎn)業(yè)集聚成勢。廣東省藥監(jiān)局全力落實省政府生物醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展行動方案,開展藥械審評重心前置、研審聯(lián)動、滾動審評、AI輔助。2025年以來,全省共獲批16個創(chuàng)新藥和17個創(chuàng)新醫(yī)療器械。
2025年,康方生物自主研發(fā)的核心產(chǎn)品之一依沃西單抗獲批新適應癥。康方生物聯(lián)合創(chuàng)始人張鵬博士談及此事表示,藥監(jiān)部門對創(chuàng)新企業(yè)的指導和支持是中國生物醫(yī)藥近年持續(xù)高質(zhì)量發(fā)展重要原因。創(chuàng)新藥的申報上市是流程規(guī)范、要求嚴謹、科學性強、復雜程度較高的過程,在公司五款創(chuàng)新藥物的上市過程中,藥監(jiān)部門都給予了高價值的意見和建議。

康方生物細胞工藝科學家正在進行實驗。新華網(wǎng)發(fā)(受訪者供圖)
張鵬以2025年獲批PD-L1陽性非小細胞癌適應癥的依沃西單抗舉例道,憑借臨床數(shù)據(jù)和創(chuàng)新性的作用機制,在臨床研發(fā)期間獲得國家藥監(jiān)局突破性治療藥物資格認定,在上市申請階段獲得優(yōu)先審評審批資格,極大加速了產(chǎn)品上市進程。
他尤其提到,在前期撰寫申報資料的過程中,藥監(jiān)部門建議在“工藝開發(fā)歷史”部分,企業(yè)將產(chǎn)品工藝開發(fā)過程中涉及的工藝版本、批號、用途、原材料、場地等內(nèi)容,通過列表的形式逐一呈現(xiàn)。在產(chǎn)品需要進行的可比性研究方面提出了詳盡的指導,明確申報資料內(nèi)容的同時優(yōu)化了資料形式,使得申報材料更全面具體,節(jié)約了與審評人員的溝通時間,有效推進了審評過程。在材料準備過程中公司也加深了對創(chuàng)新藥申報的理解,在后續(xù)產(chǎn)品及適用癥的申報上能夠?qū)a(chǎn)品的技術優(yōu)勢描述得更加清晰、順利推動新藥申報和獲批的進程。
張鵬表示,在產(chǎn)品擴大產(chǎn)能的過程中,康方生物也在廣東省藥監(jiān)局細心和全面的幫助下,與國家藥監(jiān)局積極溝通。通過有關部門的指導,企業(yè)科學研判上市后產(chǎn)品增加產(chǎn)線的變更等級,滿足包括全球患者在內(nèi)的在臨床上更廣泛的需求。監(jiān)管部門的政策創(chuàng)新和幫助,使企業(yè)能夠加速研發(fā),讓患者及時用上創(chuàng)新藥物,也為廣東省乃至全國創(chuàng)新生物醫(yī)藥產(chǎn)業(yè)的發(fā)展做出了重大的貢獻。藥物上市是藥物創(chuàng)新價值真正向社會價值和經(jīng)濟價值轉(zhuǎn)化的重要一步。
張鵬說,近年來國家和地方出臺了一系列相關政策,支持創(chuàng)新藥產(chǎn)業(yè)的全鏈條發(fā)展,這些創(chuàng)新舉措能夠使創(chuàng)新藥的可及性真正地落到實處、提高患者的保障水平,并讓企業(yè)更敢于投資,敢于研發(fā),敢于創(chuàng)新。產(chǎn)品的獲批上市僅僅是全生命周期管理的第一步,因此公司也在開發(fā)新的適應癥滿足更廣大腫瘤患者的需求,“讓患者更早地從創(chuàng)新產(chǎn)品中獲益,是企業(yè)的重要使命和目標。”
此外,廣東省藥監(jiān)局還充分發(fā)揮生物醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展工作專班工作機制優(yōu)勢,會同工信、衛(wèi)健、醫(yī)保等部門統(tǒng)籌重點項目研發(fā)及產(chǎn)業(yè)化要素保障,形成創(chuàng)新藥械產(chǎn)品目錄(第一批)共107種,研究支持創(chuàng)新藥械入院措施,助推解決創(chuàng)新藥械入院難、使用難的問題。
提速保質(zhì)增效 貫通聯(lián)動國家重大藥械審評審批改革
2024年11月,國家藥監(jiān)局發(fā)布了《關于同意北京等十省(市)開展優(yōu)化藥品補充申請審評審批程序改革試點的批復》,優(yōu)化藥品補充申請審評審批程序,其中,廣東省首批獲國家藥監(jiān)局批準開展優(yōu)化藥品補充申請審評審批程序改革試點,實現(xiàn)廣東品種在國家藥監(jiān)局的審評審批時限從200個工作日壓縮至60個工作日。據(jù)了解,廣東省藥監(jiān)局目前已接收64個申請,完成58個審評,其中8個已獲國家藥監(jiān)局批準。
廣州瑞爾醫(yī)藥聯(lián)合創(chuàng)始人、總經(jīng)理馮衛(wèi)介紹,我國藥品變更管理模式下,企業(yè)推動藥品的技術升級迭代會面臨諸多的變更需求,其中中等及微小變更企業(yè)可及時實施,重大變更則需要經(jīng)過國家藥監(jiān)局審批以后方可執(zhí)行。審批時限成為制約企業(yè)產(chǎn)品快速迭代的限速步驟。
馮衛(wèi)表示,公司獲悉廣東省作為試點省份開展補充申請前置服務后,迅速向廣東省藥監(jiān)局進行申報。在廣東省藥監(jiān)局的助力下,審評審批時限由原來的200個工作日縮減到了45個工作日,“公司產(chǎn)品從向國家藥監(jiān)局提交補充申請到獲得批件全程僅用了47個工作日。在申報的過程中,企業(yè)真切感受到了改革以后速度和效率雙提升的成效。”
馮衛(wèi)說,廣東省藥監(jiān)局始終堅持程序不減、標準不降,全程聯(lián)動協(xié)調(diào),高效銜接受理、審評、檢驗、核查的全環(huán)節(jié),推動全流程提速增效,為藥品上市按下快進鍵。作為試點省份,廣東省藥監(jiān)局也秉持“提前介入、一企一策、全程指導、研審聯(lián)動”原則,推動公司藥品進入前置服務的通道,全程“手把手”悉心指導,親力親為護航產(chǎn)品順暢申報,使企業(yè)切實享受到了政策紅利。

2025年1月,廣東省藥監(jiān)局審評認證中心藥械注冊指導服務黃埔工作站舉辦廣東省第二類重組膠原蛋白類產(chǎn)品生產(chǎn)企業(yè)審評檢查前置服務線下集中溝通咨詢專場,集中解答企業(yè)申報疑難。新華網(wǎng)發(fā)(廣東省藥監(jiān)局供圖)
馮衛(wèi)表示,試點后在申報的各環(huán)節(jié),廣東省藥監(jiān)局全程給予企業(yè)大力支持,也讓瑞爾醫(yī)藥這樣一家專注急救、搶救、解毒藥企業(yè)的產(chǎn)品快速利用政策試點進行申報,使產(chǎn)品能夠快速落地、快速獲批、快速投放市場、快速惠及患者。“特別感謝廣東省藥監(jiān)局讓我們真切感受到了‘廣東速度’。”
而對于應當如何借力政策利好的問題,馮衛(wèi)也表示,企業(yè)應深挖補充申請前置服務政策的潛力,加速產(chǎn)品上市提升市場競爭力、實現(xiàn)降本增效,為產(chǎn)業(yè)高質(zhì)量發(fā)展注入動力。如及時掌握補充申請前置服務相關政策動態(tài);提前與監(jiān)管部門溝通交流,規(guī)范申報資料,提高一次性通過率;強化人才培養(yǎng),構建高效協(xié)助機制以快速響應前置服務中的問題和要求等等。
持續(xù)深化藥品監(jiān)管改革創(chuàng)新 多維度促進全省醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展
2025年,廣東省藥監(jiān)局續(xù)深化藥品監(jiān)管改革創(chuàng)新,積極推動生物制品分段生產(chǎn)試點,珠海聯(lián)邦生物利拉魯肽注射液獲批準上市,成為全國首個實現(xiàn)產(chǎn)能轉(zhuǎn)化的試點品種。珠海聯(lián)邦因此實現(xiàn)產(chǎn)能快速擴增,其生產(chǎn)的胰島素注射液成功獲得巴西國家集采訂單,首批供貨8000萬支。
在支持醫(yī)療機構制劑高質(zhì)量發(fā)展方面,廣東省藥監(jiān)局聯(lián)合省工信廳等部門發(fā)布《關于支持廣州市帶動全省醫(yī)療機構制劑產(chǎn)業(yè)高質(zhì)量發(fā)展的若干措施》,會同省醫(yī)保局、中醫(yī)藥局、科技廳建立完善“嶺南名方”品種庫,持續(xù)推進醫(yī)療機構中藥制劑質(zhì)量提升及向中藥新藥轉(zhuǎn)化,出臺《2025年推進醫(yī)療機構制劑轉(zhuǎn)化重點品種目錄(首批30個)》,進一步培育重點轉(zhuǎn)化品種。
在監(jiān)管能力強化方面,廣東省藥檢所成為全國首家獲得放射性藥品檢驗授權的省級機構,廣東省率先建成全國首家新國標Ⅰ級生物制品(疫苗)批簽發(fā)實驗室。省醫(yī)械所持續(xù)推進醫(yī)用機器人、可用性可靠性、放射性治療器械等重點領域檢驗能力建設。在廣州市黃埔區(qū)、南沙區(qū)和佛山市、中山市、珠海市、東莞市、梅州市等產(chǎn)業(yè)集聚區(qū)設立藥械注冊指導服務工作站,加快創(chuàng)新產(chǎn)品轉(zhuǎn)化落地。

2025年2月,廣東省藥監(jiān)局審評認證中心藥械注冊指導服務佛山工作站啟動運行。新華網(wǎng)發(fā)(廣東省藥監(jiān)局供圖)
在藥品監(jiān)管科學研究方面,6家單位成功入圍國家藥監(jiān)局監(jiān)管科學創(chuàng)新研究基地現(xiàn)場核查名單,入圍數(shù)量占全國總量的五分之一。智慧監(jiān)管工具應用方面,廣東省在全國率先推出AI免費輔助工具“粵安評”,有效提升化妝品完整版安評報告提交率,大大降低企業(yè)成本。開發(fā)化妝品輔助備案審查工具“粵妝評”,提高備案審核效率和質(zhì)量。啟動“人工智能+藥品監(jiān)管”三年行動,加快推進監(jiān)管新工具、新標準、新方法開發(fā)運用。

